Запах и борьба с коррозией в системах водоотведения и канализации
Системы канализации коллекции уже давно подвергается вопросы запаха и коррозии, что вполне объяснимо, учитывая характер того, что они передают. Канализация запах, гнилой запах яйца почти каждый испытал, является локализованной и политическая проблема и является движущей силой реализации управления в системах канализации коллекции.
Коррозия, однако, вопрос, имеющие наибольший потенциал для вреда окружающей среде и реальный системный и экономический ущерб, в том числе взрыв трубы, деградация станции подъемника и другого оборудования и системных сбоев. Неудачи этого типа требуют ремонта и замены системы сбора материалов и оборудования, и имеют потенциал, чтобы выставить среду к непредсказуемым выбросов опасных отходов, которые трудно содержать и восстанавливать. По данным 2009 года ASCE в табеле инфраструктуры [ASCE, 2009], где класс «D-» был дан:
"Старение систем разряда миллиардов галлонов неочищенных сточных вод в воды США поверхность каждый год. По охране окружающей среды считает, что страна должна инвестировать $ 390 млрд в течение следующих 20 лет, чтобы обновить или заменить существующие системы и строить новые, чтобы удовлетворить растущий спрос ».
СероводородИз основных причин запаха и коррозии является сероводород (H2S) и связанных с ним соединений. Все отходы жизнедеятельности человека и в дальнейшем, все сточные воды, содержащие соединения серы, которые обеспечивают молекулярную основу для генерации сероводорода. Сероводород возникает из комбинации анаэробных условий и наличия сульфиты и сульфаты в соединении с колониями микроорганизмов, присутствующих на внутренних стенках всех систем сбора, называют слизь слоя.
Сульфат бактерий (SRB) будет использовать эти соединения в отсутствии свободного кислорода (O2) для обмена веществ. Эти бактерии не используют серу компонент, и это доступно в реакцию с водой, в частности, свободных протонов (Н +), что приводит к образованию сероводорода. Это поколение путь может быть представлена следующим сбалансированной реакции [Matthews, 2010]:
(1) SO 4 2 - → S 2 -
(2) S 2 - + H 2 O ↔ HS - + OH -
(3) HS - + H 2 O ↔ H 2 S (ая) + OH -
(4) H 2 S (ая) ↔ H 2 S (г)
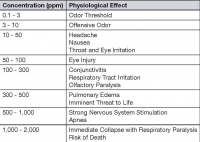
После своего поколения, сероводород могут быть выпущены в атмосферу (см. формулу 4) и найти свой путь к рецепторам через люки или другие узлы атмосферы и системы сбора, в какой момент это запах беспокойства. Сероводород представляет собой бесцветный газ, который имеет характерный запах гнилого яйца, очень токсичен и очень коррозию некоторых металлов. Он тяжелее воздуха, то есть он может накапливаться в колодцы, люки и другие подобные места, которые не имеют хорошей вентиляцией. Его воздействие на человека, при различных концентрациях по сравнению с окружающим воздухом, показано в таблице 1 [EPA, 1985].
Таблица 1. Сероводород последствий для здоровья в различных концентрациях
Сероводород становится коррозия вопрос, когда он вступает в контакт с влажным бетона или стали, наряду с другими металлами, в присутствии кислорода, даже при очень низких концентраций газообразной. Такие условия, как это довольно часто в голове пространство некоторых труб, а также в колодцы, насосные станции и в других областях, в которых система сбора обеспечивается легкий доступ к атмосферным кислородом. Бактерии в этих областях могут преобразовать H2S в серную кислоту (H2SO4), которая затем начинает реагировать с инфраструктурой в разрушительный путь.
Исторически сложилось, что контроль запаха и / или коррозии была реализована либо через паровой фазы техники, где глава пространство станции подъемника лечится, или жидкой фазе методов, где процедуры нацелены на поток жидкости. Паровой фазе лечения, такие как скрубберы, не обеспечивают контроль коррозии, в отличие от жидких фаз методов, некоторые из которых может предложить борьбы с коррозией.
Наиболее распространенный способ вызывать жидкий фазы лечения или непосредственно лечения сточных вод в системы сбора, был на капельного дозирования химических веществ в системы. Постоянный и непрерывный дозы химических подается из большого резервуара с небольшой насос в системе сбора, как правило, в люк или насосные станции. Эти вещества предназначены для взаимодействия с запахом вызывают соединения, присутствующие в сточных водах или прекратить их формирования и / или освобождения от решения. Основные классы реакций, используемых для контроля сероводорода кратко описаны в этом разделе.
Окисление
Химического окисления сероводорода осуществляется с помощью соединения с высоким окислительным потенциалом, называется окислителем, таких как перекись водорода или гипохлорита натрия (отбеливатель). Этот метод лечения включает в себя прямого окисления H2S в более мягких формах, таких как сульфиты, сульфаты и элементарная сера. Тем не менее, не влияет на наличие SRB, которые, вероятно, продолжит расти со временем. После прекращения лечения, выражение сероводорода может быть даже хуже, чем раньше, за счет увеличения объемов выпуска растущий слой SRB. Кроме того, вполне вероятно, что увеличение объемов химической обработки необходимо будет со временем по той же причине.
Сульфидные Мусорщики (соли железа)
Химические вещества, которые взаимодействуют с сероводородом и секвестр, или мусор, серы в относительно нерастворимые формы, такие как хлорид железа и хлористого железа, могут быть использованы для удаления серы из цикла полностью. Эта процедура не влияет на наличие или производство слой SRB и прекращения использования увидим возвращение к выбросов сероводорода, возможно, на Повышенный уровень. По этой причине, вполне вероятно, что более широкое использование времени будет действовать, как хорошо.
Эти химические вещества будет активно удалить делать из сточных вод; может служить весы на железных поверхностях, таких как трубы и насосы, а также может стать постоянным источником осаждения в результате реакции железа с серой, образуя осадок FeS в систему сбора. Продолжение и / или повышенный риск коррозии является важной задачей с использованием черных и хлорид железа, за счет генерации кислот в составе очистки реакции. Примером реакции, в которых соляная кислота образуется показано в уравнении 5.
(5) 3H 2 S + 2FeCl 3 → S + + 2FeS 6HCl
Основная часть того масштаба железа в системе сбора и представляет опасность загрязнения вниз по течению твердых тел. На самом деле, о всеобъемлющем экологического ущерба, компенсации и ответственности закон (CERCLA) считает, соли железа постоянной экологической опасности [США перекиси, 2011]. Этот аспект может значительно добавить к расходам, растений и твердых веществ биологического происхождения обработки.
рН
Из-за того, каким образом его ионы диссоциируют в водной фазе, освобождения от сероводорода сточные воды не произойдет, если рН в 9 или выше. Благодаря использованию соединений, которые могут индуцировать и поддерживать значительное увеличение рН, такие как гидроксид натрия или гидроксид магния, можно воспользоваться этой чертой и "ловушки" сульфида в растворе. Это может быть дорогостоящий процесс, в связи с объемом химической обработке, необходимой для поддержания повышенного уровня рН и относительно высокие расходы на галлон (литр).
Кроме того, лечение химическими веществами может быть трудно поддерживать решения, особенно в холодную погоду. Хорошей иллюстрацией этого является гидроксид магния, который имеет растворимость только 0,012 граммов на литр воды, граничащие с линией неразрешимости. Существует, опять же, никакого лечения или уменьшения SRB, которые могут вызвать проблемы расти со временем. Кроме того, когда рН падает ниже 9, а может произойти вниз по течению от лечения и / или на очистные сооружения, сероводород легко выпустили, возможно, на повышенной скорости в связи с увеличением концентрации раствора.
Альтернативный источник кислорода / Сульфат замену
В анаэробной среде, микробиологии в коллекции система будет использовать кислород из нитратов (NO 3) молекулы легче, чем из сульфата (SO 4) выпуск доброкачественной азота, чем сероводород. Химические вещества, такие как кальций или нитрат натрия, коммерчески доступны и могут быть использованы для этой цели. Эти химические вещества являются дорогими, и они питаются и растут слой SRB, потенциально требующих большего объема лечения с течением времени. После прекращения лечения, выражение сероводорода может быть хуже, чем раньше.
Превышение влажный и монтажа, требующих повышенной очистки циклов в связи с добавлением воска используется для стабилизации нитрата молекул, можно встретить ниже по течению. Кроме того, новые федеральные и государственные правила начинают включать концентрации нитратов в разряд ограничений. Редко есть много режиме реального времени, активного контроля уровня сточных вод сульфид, поэтому достаточно химического контроля пиковых значений H2S обычно добавляется на постоянной основе. Рассматривая для пиковых значений с химическими веществами, такими, как эти, избыток нитратов, вероятно, будет настоящим и активно добавляются в сточных водах, требующих дополнительных процессов денитрификации и штрафов, оба из которых могут быть дорогими.
Новое решение, озона и кислородаВопрос со всеми химической обработки заключается в том, чтобы ввести их в систему сбора, массовом количестве должны храниться рядом. Для того, чтобы химические вещества всегда доступны для лечения, продолжает поставки в объем резервуара для хранения должно произойти. Для того, чтобы окружающая среда не пострадали (непосредственно), разработаны элементы управления, такие как вторичная защитная оболочка и мониторинга утечек, должна быть разработана, внедрена и поддерживается. По сути, деньги вливаются в трубу на постоянной основе без реального решения проблемы происходят.
В идеале, успешное лечение запах сточных вод и коррозии перестанет сульфида производства, устранения сульфидов, которые присутствуют, не представляют дополнительную опасность для жизни или окружающей среды, не навредить в коллекцию самой системы и не создавать дополнительные трудности по течению. Кроме того, оно должно быть экономически эффективным. Такое решение становится доступным через новый подход введения озона и кислорода в системах сбора, как средство запах и борьбы с коррозией.
Озон уже давно используется в сфере очистки воды, начиная, по крайней мере в конце 19 века, в первую очередь для дезинфекции и полировки питьевой воды [Бельтран, 2004]. В Европе, озонирование воды общего процесса [Lenntech, 1998]. Начальник экологической озона устойчивости и относительной безопасности по сравнению с химическими системами, утвердили ее как благоприятствования текущих и будущих технологий.
Контролируемое использование озона для лечения не дает никаких вредных побочных продуктов, которые могут загрязнить или повредить окружающей среде и экологии. Как правило, только побочные продукты от реакции O2 и инертных оксидов. В последнее время интерес к ее использованию в сточных водах промышленности привело к разработке новых и устойчивых (зеленый) технологии для лечения запаха и коррозии в системе сбора сточных вод.
Озон является особым, природной формы кислорода воздуха. Вместо двух атомов кислорода имеет три, в лице O3 химическую формулу. Этот третий атом кислорода делает его высоко реактивные молекулы с высоким окислительным потенциалом. Он имеет высокий окислительный потенциал любого коммерчески доступных молекул и четвертое место общего с окислительным потенциалом 2,07 В. Над ним, в окислительный потенциал, являются атомарного фтора (F •, 2.87 V), гидроксильных радикалов (OH •, 2,86 V ) и атомарного кислорода (O •, 2.42 V). Озон может быть создан путем возбуждения поток кислорода с достаточной электрической или оптической энергии. Это вызывает определенное количество атомов кислорода к расколу и рекомбинировать с другими молекулами O2 неподалеку. Это показано в уравнении 6.
(6) 3O 2 + энергия → 2O 3
В обычных условиях лечения, используя относительно чистый поток кислорода и короны разрядной камере, в которой используется высокое напряжение электрической дуги, эта реакция может производить до 9 до 12 весовых процентов (мас.%) озона [Drago, 2010], хотя обычно выход в 1 до 9% масс озона [PTI, 2011]. Остальная часть потока остается, как кислород. Концентрация ограничена этой области, потому что реакции показано в уравнении 7.
(7) 2O 3 → 3O 2
Поскольку озон количество подняться выше этой концентрации, уничтожение реакции (7) становится все более частыми, поэтому возвращение большего количества О2 и поддержании этого равновесия. Эта неустойчивость и почему озон не могут быть сохранены и должны быть получены непосредственно перед применением.
Из-за своей крайней нестабильностью и высоким окислительным потенциалом, озон является мощным и неразборчив в своих реакциях с другими видами химических веществ. Озон был показан в качестве эффективного лечения для уничтожения летучих органических соединений (ЛОС), удаление металлов, взвешенных твердых веществ, органического углерода, к значительному снижению химического потребления кислорода (ХПК) и многое другое. В пресной воде, период полураспада озона, как правило, от 10 до 20 минут. В сточные воды, озона была описана как быть полностью потребляются в течение 8,6 секунды [Терри, 2010]. Это связано с крайне количество потенциальных реагентов, которые присутствуют в сточных водах, главным из которых для целей настоящей статьи, является сероводород. Простая структура сероводорода делает его легкой мишенью для окисления озоном.
В дополнение к высокой окисления, структура озона ведет к созданию свободных радикалов, химических веществ, которые несвязанных электронов делает их высокой реакционной способностью, особенно в воде. Мало того, в пользу прямой реакции озона с различными видами химической понял, а как часть этих реакций, дополнительные свободные радикалы могут образовываться, которые могут быть более реактивной, чем озон. Эти новые радикалы, как правило, создают больше радикалов, как они реагируют, в результате чего свободные радикалы цепная реакция, называется косвенное воздействие озона.
Так как источник озона является атмосферный воздух, она является конечной, устойчивых зеленых химической обработки. В настоящее время технология получения озона выиграли от более чем 45 лет непрерывного развития, в результате экономически эффективной и надежной работы. Используя только кислород сепаратор, корона разрядной камеры и некоторые компрессоров и других электрических компонентов, на месте поколение озона является простым и безопасным сегодня. Это резко контрастирует с большинством других современных коммерчески доступных методов лечения.
Благодаря методу производства озона, кислорода также будет частью коктейль подготовки газа, который является полезным, потому что кислород является окислителем. В окислительный потенциал 1,23 В, кислород реагирует медленнее, чем озона, но является отличным дополнением. Помимо оказания помощи в окислении, его основным преимуществом является увеличение растворенного кислорода (DO) концентрации сточных вод, стимулирования роста аэробных бактерий. Эти бактерии не пахучие, агрессивных или вредных для систем сбора данных. НЕ также исключает возможность SRB для получения сульфидов, либо путем SRB и способствует росту аэробных видов поверх которые окисляют сульфиды любой, прежде чем войти в поток сточных вод [EPA, 1985].
С точки зрения надежной и зеленый метод для лечения и профилактики запаха и коррозии, кислород и озон комбинации в верхней части списка. Кислород широко доступны, примерно 21 процентов атмосферы, и легко превращается в озон. Поколения и настой из этих двух газов в системах сточных вод коллекции оказалась чистой, безопасной и экономически эффективной.
Первый способ действия является мощным разрушительным воздействием озона на сероводород, быстро превращая его в сульфиты и сульфаты на контакт. Кроме того, антибактериальные свойства озона может помочь уменьшить SRB и других микроорганизмов на стенках труб. Как продукт его реакции, кислород вырабатывается. Это добавляет больше кислорода коктейль подготовки газа, которая обеспечивает вторичную обработку, увеличивая DO, и обеспечивает более полное использование придают газы лечения.
Из-за неизбирательного озона и мощные окислительные характеристики, беспокойство, иногда подняты, что озон может атаковать сточных вод самой инфраструктуры. Это вряд ли, особенно в сточных водах, где жидкость настой фазе реализации. Это связано с высоким соотношением объема жидкости по сравнению с трубой площадь поверхности на единицу длины трубы и наличие реагентов в жидкой части. Маловероятно, что озон достаточно долго, чтобы повлиять на сточные воды инфраструктуры.








